La OMS y otras asociaciones de expertos no encuentran motivos para desaconsejar la administración de la vacuna de la Covid-19 en embarazadas. Vacuna de la Covid-19 en madres lactantes y embarazadas Cuando se empezó a…
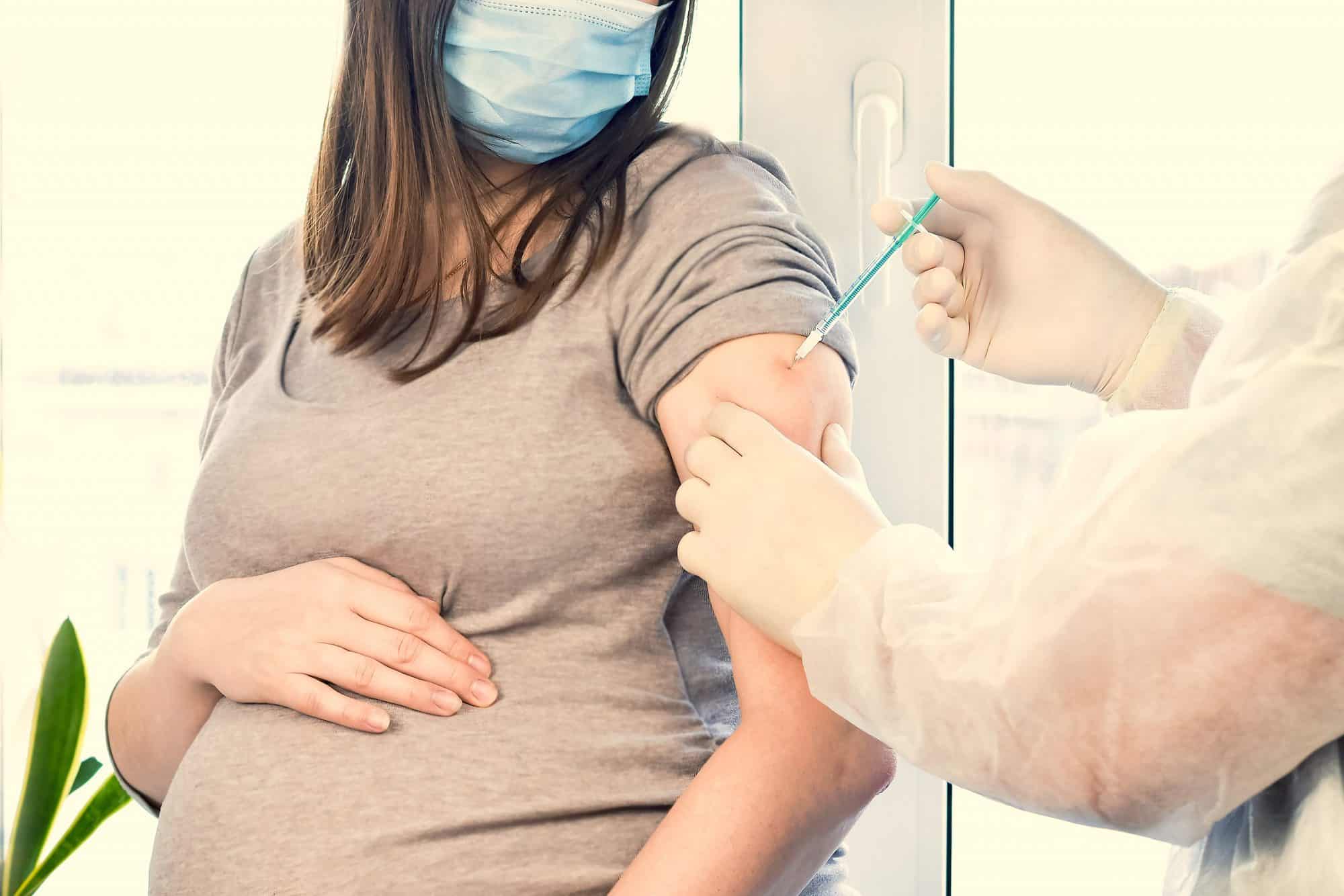
Pfizer y BioNTech evalúan su vacuna Covid-19 en embarazadas mediante un estudio aleatorizado, controlado con placebo y ciego en aproximadamente 4.000 mujeres embarazadas sanas mayores de edad vacunadas durante las 24 a 34 semanas de gestación.
Estudio global de la vacuna vacuna Covid-19 en embarazadas
Los laboratorios Pfizer y BioNTech han anunciado que se ha administrado la dosis a las primeras participantes en un estudio global de fase 2/3 para seguir evaluando la seguridad, tolerabilidad e inmunogenicidad de su vacuna contra la Covid-19 en mujeres embarazadas sanas mayores de 18 años.
El objetivo de este ensayo clínico es ampliar la vacunación contra el coronavirus a otras poblaciones vulnerables, como las mujeres embarazadas, que tienen un mayor riesgo de complicaciones y de desarrollar Covid-19 grave.

Según comenta el vicepresidente senior de Investigación y Desarrollo Clínico de Vacunas de Pfizer, William Gruber:
“Estamos orgullosos de iniciar este estudio en mujeres embarazadas y de seguir reuniendo las pruebas de seguridad y eficacia para apoyar potencialmente el uso de la vacuna por parte de subpoblaciones importantes. Las mujeres embarazadas tienen un mayor riesgo de complicaciones y de desarrollar Covid-19 grave, por lo que es fundamental que desarrollemos una vacuna que sea segura y eficaz para esta población. Estamos profundamente agradecidos a las voluntarias que se están inscribiendo en el ensayo y a los investigadores del centro que están dirigiendo este trabajo”.
Además, el estudio también evalúa la seguridad de la vacuna contra la Covid-19 en los bebés de las madres gestantes vacunadas, por lo que dicha evaluación atendería a una doble necesidad: la de proteger del coronavirus tanto a las mujeres embarazadas como a sus bebés, como manifiesta el director médico de BioNTech, Özlem Türeci:
“Permitir un amplio acceso a nuestra vacuna Covid-19 de gran eficacia es un objetivo importante para nosotros. Ahora que estamos viendo el éxito de la implementación inicial de las campañas de vacunación en todo el mundo, es el momento de dar el siguiente paso y ampliar nuestro programa clínico a otras poblaciones vulnerables, como las mujeres embarazadas, para proteger potencialmente tanto a ellas como a las generaciones futuras“.
Antes de llevar a cabo su ensayo clínico en mujeres embarazadas, Pfizer y BioNTech completaron una investigación de toxicidad requerido por las autoridades reguladoras. Estos estudios no mostraron ninguna evidencia de toxicidad para la fertilidad o la reproducción en los animales.

Además, para asegurarse los resultados, los laboratorios harán un seguimiento a los hijos de las participantes tras el parto, hasta los seis meses de vida de los bebés.
Los datos del estudio
Se trata de un ensayo de fase 2/3, diseñado como un estudio aleatorizado, controlado con placebo y ciego a los observadores en aproximadamente 4.000 mujeres embarazadas sanas, de más de 18 años, vacunadas durante las 24 a 34 semanas de gestación.
Los estudios clínicos en fase 2/3 son ensayos avanzados que tratan de determinar si es eficaz el tratamiento (fase 2) y si es mejor el nuevo tratamiento bajo estudio que el tratamiento convencional (fase 3). Su anonimización o estudio ciego significa que es un experimento en el cual los participantes no saben si están recibiendo el tratamiento o bien se les está administrando un placebo. Esta metodología es empleada para evitar cualquier tipo de sesgo hasta que el ensayo haya concluido.

Finalmente, el estudio evaluará la seguridad, tolerabilidad e inmunogenicidad de dos dosis de la vacuna o de placebo, administradas con 21 días de diferencia. Las mujeres embarazadas participarán en el estudio durante aproximadamente 7 a 10 meses, dependiendo de si fue aleatorizada para recibir la vacuna o el placebo.
En el protocolo del estudio se establece que, después de que nazca el bebé de una participante, la mujer que forma parte en el ensayo materno será desenmascarada y las que estaban en el grupo de placebo recibirán la vacuna.
Estudian la transferencia de anticuerpos a los bebés e iniciarán estudios de la vacuna Covid-19 en niños
El estudio evaluará la seguridad de la vacuna en los bebés de las mujeres embarazadas vacunadas y la transferencia de anticuerpos potencialmente protectores a los pequeños. Para asegurar los resultados, los bebés serán controlados hasta aproximadamente los seis meses de edad.

Adicionalmente, Pfizer y BioNTech esperan iniciar más estudios en niños de entre 5 y 11 años “en los próximos meses”, y en niños menores de 5 años “más adelante en 2021”. La seguridad y la eficacia en personas de 12 a 15 años ya se están evaluando en un estudio global de fase 3 y está previsto presentar los datos pertinentes a las autoridades reguladoras “en el segundo trimestre de 2021”.
Asimismo, las compañías también están planeando estudios para evaluar la vacuna en personas con sistemas inmunológicos comprometidos, con el objetivo de ampliar la vacunación contra la Covid-19 al mayor grupo posible de población mundial.
También te puede interesar...
-
Vacuna de la Covid-19: Los expertos ya SÍ recomiendan vacunarse a embarazadas y madres lactantes
-
¿Tenemos ya vacuna contra la Covid-19?
La noticia del día es la comunicación por parte del laboratorio Pfizer y BioNTech de que su vacuna contra la Covid-19 ha demostrado un 90% de efectividad en un primer análisis de eficacia. ¿Es eficaz…
-
AstraZeneca prueba la primera vacuna del Covid-19 en niños
La universidad inglesa de Oxford inició el sábado pasado pruebas clínicas para comprobar la eficacia de su vacuna del Covid-19 en niños de 6 a 17 años. El laboratorio británico ha elaborado la vacuna anticovid…
Buscar
Nuestros Cursos
Lo más leído
- Beneficios de la lactancia nocturna
- Doctora, tiene un bultito en el pecho: ¿qué puede ser?
- Sanidad alerta sobre el alto contenido en mercurio de cuatro pescados y recomienda no dárselos a los niños hasta los 10 años
- Bebés de alta demanda: ¿cómo saber si tu hijo es uno de ellos?
- Esas madres y esos padres hippies que no saben lo que hacen
- Nuevo «Mi primer Danone» sin azúcares añadidos: por qué no lo recomendamos
Categorías
- Alimentación Complementaria
- Alimentación con fórmula
- Alimentación infantil
- Crianza Respetuosa
- Desarrollo infantil
- Educación Emocional
- Educación infantil
- Educación Sexual
- Embarazo
- Familias con animales
- Fertilidad
- Juego y juguetes
- Lactancia materna
- Literatura infantil
- Manualidades
- Maternidad y paternidad
- Parto
- Pedagogía Montessori
- Planes en Familia
- Porteo Infantil
- Posparto
- Psicología Infantil
- Recién nacido
- Salud de los Progenitores
- Salud infantil
- Segunda infancia y adolescencia
- Seguridad en el coche
- Seguridad Infantil
- Sueño infantil














0 comentarios en "Ensayo clínico mundial: Evalúan la vacuna Covid-19 en embarazadas"